令和元年12月実施(第70回)環化 問15
※怒られるといけないので問題文は載せません。
令和元年12月実施(第70回)環化 問15
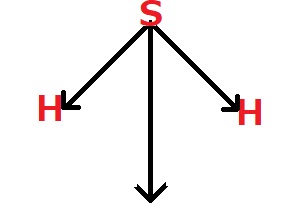
硫化水素の双極子モーメントから、S-Hの結合モーメントを求める問題。
双極子モーメントは
H-S-Hの結合角は90°
正解)
解説)
S-Hの結合モーメントをXと置く。
令和元年12月実施(第70回)環化 問14
※怒られるといけないので問題文は載せません。
令和元年12月実施(第70回)環化 問14
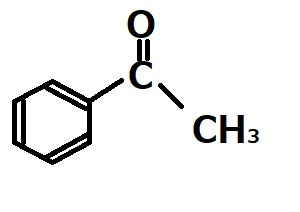
硫酸と硫酸水銀を触媒にした、エチニルベンゼン の水和反応で得られる主生成物。
正解)
解説)
今回の問題のような水銀イオン触媒によるアルキンの水和反応では、マルコフニコフ型の生成物が得られる。従って下記のようなエノールが得られると予想されるが、得られたエノールはすぐにケトンに転移してしまうため、主生成物は上記の1-フェニルエタノンになる。
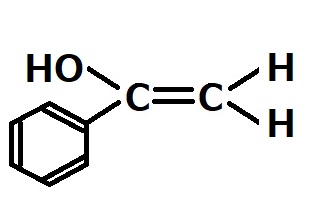
(補足)
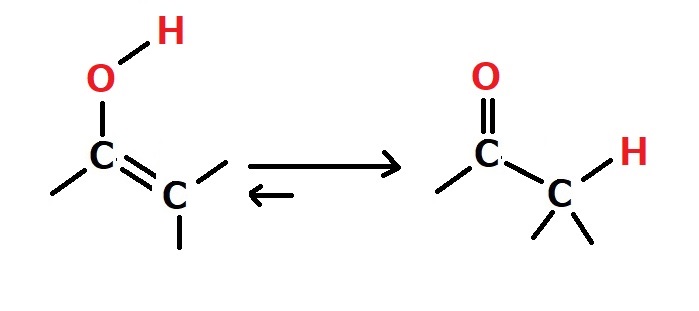
・ケト-エノール互変異性体
ケト形とエノール形を素早く相互変換しているが、平衡はケト形に偏っていて、エノールはほとんど単離されない。
・マルコフニコフ則
アルケンへのハロゲン化水素の付加反応において、水素はアルキル置換基がより少ない炭素に付き、ハロゲンはアルキル置換基の多い炭素に付く法則。
水の付加反応の場合にも応用できる。
・ヒドロホウ素化酸化
水銀イオン触媒による水の付加においてはマルコフニコフ型の生成物が得られるが、ヒドロホウ素化酸化による水の付加では非マルコフニコフ型の生成物になる。
令和元年12月実施(第70回)環化 問11
※怒られるといけないので問題文は載せません。
令和元年12月実施(第70回)環化 問11
錯イオンの酸化数を比べる問題。
正解)
解説)
Oの酸化数は-2なので Cr + (-2) × 4 = -2 からCrの酸化数は+6
Brの酸化数は-1なので Ni + (-1) × 4 = -2 からNiの酸化数は+2
CNの酸化数は-1なので Cu + (-1) × 3 = -2 からCuの酸化数は+1
COの酸化数は0なので Fe + 0 × 4 = -2 からFeの酸化数は-2
令和元年12月実施(第70回)環化 問10
※怒られるといけないので問題文は載せません。
令和元年12月実施(第70回)環化 問10
濃度を示す量についての関係式で正しいもの選択肢から選ぶ問題。
正解)
溶質の質量濃度=溶質の物質量濃度×溶質のモル質量
解説)
1)
溶質の質量分率=溶質の質量濃度×溶液の密度 (誤)
↓
溶質の質量分率=溶質の質量濃度÷溶液の密度 (正)
単位を考える。
はおかしいので誤り。
別の方法
溶質の質量分率0.20で溶液の密度の溶液を考えてみる。
この溶液の質量は1100kg。
溶質の質量は質量分率から
よって、質量濃度は
は成立しないの誤り。
2)
溶液の物質量濃度=溶質の物質量÷溶液の質量 (誤)
↓
溶液の物質量濃度=溶質の物質量÷溶液の体積 (正)
単位を考える。
おかしいので誤り。
3)
溶質の質量濃度=溶質の物質量濃度×溶質のモル質量 (正)
単位を考える。
成り立つ。
モル質量に物質量をかければ質量になるので意味合い的にも正しい。
4)
溶質の物質量分率=溶質の物質量÷溶媒の物質量 (誤)
↓
溶質の物質量分率=溶質の物質量÷(溶質の物質量+溶媒の物質量)(正)
単位だけで見ると
おかしくないが、意味を考えると おかしい。
溶液全体の物質量に対しての溶質の物質量が物質量分率なので溶媒で割っているのは誤り。
5)
溶質の物質量分率=溶質の体積分率 (誤)
溶液の問題なので成り立たない、混合気体の問題であれば成立する余地はある。
令和元年12月実施(第70回)環化 問9
※怒られるといけないので問題文は載せません。
令和元年12月実施(第70回)環化 問9
2原子間で共有される電子の数がベンゼンと同じものを選ぶ問題。
正解)
オゾン
解説)
ベンゼンは各炭素原子間で、σ結合で2個の電子を共有している。他に、6個の炭素原子間でπ電子を6個共有しているので、計3個。(問題文にも3個と書いてある。)
グラファイト、ダイヤモンド、ポリエチレンは各炭素原子間で電子を1個ずつ出し合って、2個共有。
酸素分子は各原子が電子を2個ずつ出し合って、4個共有。
オゾンは3個の酸素原子が電子を2個ずつ出し合って計6個の電子を3原子間で共有しており、結合箇所は2か所なので一つの酸素ー酸素原子間で共有される電子は平均で3個と考えられる。